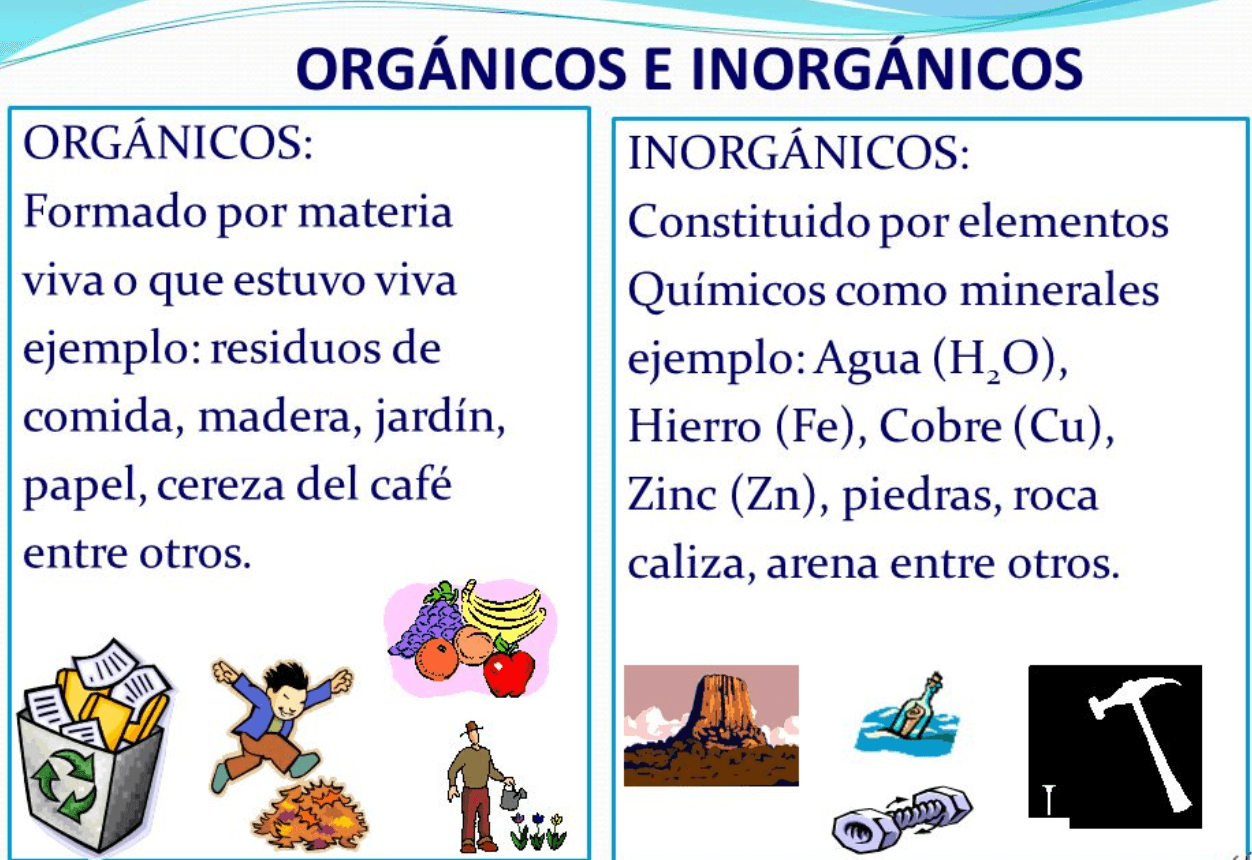
Diferenças Fundamentais entre Matéria Orgânica e Inorgânica

Diferenças Organicas E Inorganicas E Exemplos Do Dia A Dia – A principal distinção entre compostos orgânicos e inorgânicos reside na presença ou ausência de átomos de carbono e hidrogênio ligados entre si. Compostos orgânicos, quase sem exceção, contêm carbono e hidrogênio, frequentemente formando longas cadeias e estruturas complexas. Já os compostos inorgânicos, em sua maioria, não possuem essa estrutura baseada em cadeias de carbono e hidrogênio. O átomo de carbono, com sua capacidade de formar quatro ligações covalentes, é crucial para a construção de moléculas orgânicas complexas e diversas, como proteínas, carboidratos e lipídios.
Propriedades Gerais de Compostos Orgânicos e Inorgânicos
Compostos orgânicos e inorgânicos exibem propriedades físicas e químicas distintas. A tabela abaixo compara algumas dessas propriedades.
| Propriedade | Compostos Orgânicos | Compostos Inorgânicos | Observações |
|---|---|---|---|
| Ponto de Fusão | Geralmente baixo | Geralmente alto | Exceções existem em ambos os casos. |
| Ponto de Ebulição | Geralmente baixo | Geralmente alto | Dependendo da massa molar e forças intermoleculares. |
| Solubilidade em Água | Geralmente baixa (exceto compostos polares) | Variável, muitos são solúveis | Depende da polaridade da molécula. |
| Condutividade Elétrica | Geralmente baixa (exceto em soluções iônicas) | Variável, muitos são condutores em solução aquosa | Depende da natureza iônica ou metálica do composto. |
| Combustibilidade | Geralmente alta | Geralmente baixa | Muitos compostos orgânicos são inflamáveis. |
Exemplos de Compostos Orgânicos no Dia a Dia: Diferenças Organicas E Inorganicas E Exemplos Do Dia A Dia
Compostos orgânicos são essenciais para a vida e estão presentes em diversos alimentos que consumimos diariamente. A seguir, alguns exemplos e suas funções biológicas.
Exemplos de Compostos Orgânicos em Alimentos
- Glicose (Carboidrato): Fonte primária de energia para as células. Sua fórmula química é C 6H 12O 6.
- Proteína (Albumina do Ovo): Fundamental para a construção e reparação de tecidos. Composta por aminoácidos ligados por ligações peptídicas.
- Lipídio (Triglicerídeo): Reserva de energia, isolamento térmico e proteção de órgãos. Formado por glicerol e três ácidos graxos.
- Celulose (Carboidrato): Componente estrutural das paredes celulares das plantas, importante para a fibra alimentar. É um polissacarídeo formado por unidades de glicose.
- Amido (Carboidrato): Polissacarídeo de reserva energética em plantas, encontrado em batatas, arroz e trigo. Formado por unidades de glicose.
Composição Química de Carboidratos, Proteínas e Lipídios
- Carboidratos: Compostos de carbono, hidrogênio e oxigênio, geralmente na proporção (CH 2O) n. Exemplos: glicose (C 6H 12O 6), sacarose (C 12H 22O 11).
- Proteínas: Polímeros de aminoácidos, unidos por ligações peptídicas. Exemplos: albumina (presente na clara do ovo), caseína (presente no leite).
- Lipídios: Ésteres de ácidos graxos e glicerol. Exemplos: triglicerídeos (presentes em óleos e gorduras), fosfolipídios (componentes das membranas celulares).
Papel dos Compostos Orgânicos em Processos Biológicos
Compostos orgânicos desempenham papéis cruciais em processos biológicos como a fotossíntese e a respiração celular. Na fotossíntese, a energia solar é utilizada para converter dióxido de carbono e água em glicose (um carboidrato) e oxigênio. Na respiração celular, a glicose é quebrada, liberando energia para as atividades celulares e produzindo dióxido de carbono e água.
Exemplos de Compostos Inorgânicos no Dia a Dia
Compostos inorgânicos são amplamente utilizados em materiais de construção e em diversas aplicações industriais. Suas propriedades, como resistência, dureza e estabilidade, são fatores determinantes em sua utilização.
Exemplos de Compostos Inorgânicos em Materiais de Construção
- Cimento: Mistura de calcário, argila e outros materiais, que reage com a água para formar uma pasta que endurece. Sua composição química é complexa, envolvendo silicatos de cálcio.
- Areia (SiO2): Usada na fabricação de concreto e vidro. É um óxido de silício, um composto inorgânico abundante na natureza.
- Pedras (diversos minerais): Granito, mármore e outros minerais são usados na construção civil por sua resistência e durabilidade. Sua composição varia dependendo do mineral específico.
- Aço: Liga metálica de ferro e carbono, utilizada na construção de estruturas metálicas. A adição de carbono aumenta a dureza e a resistência do ferro.
- Gesso (CaSO4·2H 2O): Sulfato de cálcio di-hidratado, usado como material de construção e em moldes.
Composição Química e Aplicações de Minerais
- Quartzo (SiO2): Óxido de silício, usado na fabricação de vidro, componentes eletrônicos e abrasivos.
- Calcário (CaCO3): Carbonato de cálcio, usado na produção de cimento, na agricultura para correção do solo e na indústria farmacêutica.
- Halita (NaCl): Cloreto de sódio, o sal comum, usado como condimento, conservante de alimentos e na indústria química.
Propriedades de Metais e Sais
Metais geralmente são condutores de eletricidade e calor, maleáveis e dúcteis. Exemplos incluem o ferro (utilizado em aço) e o cobre (utilizado em fios elétricos). Sais são compostos iônicos, frequentemente solúveis em água e condutores de eletricidade em solução aquosa. Exemplos incluem o cloreto de sódio (NaCl) e o sulfato de cobre (CuSO 4).
O Carbono e suas Ligações na Matéria Orgânica
A capacidade do carbono de formar quatro ligações covalentes é fundamental para a diversidade das moléculas orgânicas. Ele pode formar ligações simples, duplas e triplas, influenciando diretamente na forma e propriedades da molécula.
Tipos de Ligações Químicas do Carbono
| Tipo de Ligação | Exemplo de Molécula | Fórmula | Observações |
|---|---|---|---|
| Simples | Etano | C2H6 | Ligação C-C |
| Dupla | Eteno | C2H4 | Ligação C=C |
| Tripla | Etino | C2H2 | Ligação C≡C |
Isomeria
Isômeros são moléculas com a mesma fórmula molecular, mas diferentes arranjos atômicos, resultando em propriedades diferentes.
- Isômeros estruturais: Diferenças na conectividade dos átomos. Exemplo: butano (normal) e isobutano.
- Isômeros geométricos (cis-trans): Diferenças na disposição espacial dos átomos em torno de uma ligação dupla. Exemplo: cis-2-buteno e trans-2-buteno.
Reações Químicas: Orgânicas vs. Inorgânicas
Reações orgânicas geralmente são mais lentas e complexas do que reações inorgânicas. Mecanismos de reação como substituição, adição e eliminação são comuns em compostos orgânicos. Reações inorgânicas, muitas vezes, envolvem transferência de elétrons ou formação de ligações iônicas.
Velocidade e Mecanismos de Reações, Diferenças Organicas E Inorganicas E Exemplos Do Dia A Dia
Reações orgânicas frequentemente requerem condições específicas de temperatura e pressão, e a presença de catalisadores pode acelerar significativamente a reação. Reações inorgânicas podem ser mais rápidas e menos específicas em relação às condições reacionais.
Influência de Catalisadores
Catalisadores são substâncias que aumentam a velocidade de uma reação sem serem consumidas no processo. Em reações orgânicas, enzimas (catalisadores biológicos) são amplamente utilizadas. Em reações inorgânicas, metais de transição e seus óxidos são frequentemente usados como catalisadores.
Combustão
A combustão completa de compostos orgânicos geralmente produz dióxido de carbono e água. A combustão de compostos inorgânicos pode produzir diferentes produtos, dependendo da composição do composto.
Implicações Ambientais
A decomposição de compostos orgânicos e inorgânicos no meio ambiente tem impactos distintos. Compostos orgânicos são geralmente biodegradáveis, enquanto a decomposição de compostos inorgânicos pode ser lenta ou inexistente.
Decomposição e Impactos Ambientais
A decomposição de matéria orgânica contribui para o ciclo do carbono, enquanto a persistência de certos compostos inorgânicos, como plásticos e metais pesados, pode causar poluição ambiental. A poluição por compostos orgânicos pode levar à eutrofização de corpos d’água, enquanto a poluição por compostos inorgânicos pode contaminar o solo e as águas subterrâneas.
Ciclo do Carbono e Ciclo da Água
O ciclo do carbono envolve a troca de carbono entre a atmosfera, os organismos vivos e o ambiente geológico. Compostos orgânicos desempenham um papel fundamental nesse ciclo, enquanto compostos inorgânicos, como o dióxido de carbono, também participam. O ciclo da água envolve a circulação da água na Terra, e a presença de compostos inorgânicos dissolvidos na água influencia suas propriedades.
Qual a diferença na decomposição de matéria orgânica e inorgânica?
Matéria orgânica decompõe-se mais facilmente que a inorgânica, devido à ação de microrganismos. A decomposição inorgânica geralmente envolve processos geológicos mais lentos.
Quais são os principais ciclos biogeoquímicos envolvendo compostos orgânicos e inorgânicos?
O ciclo do carbono e o ciclo do nitrogênio são exemplos importantes. O carbono circula entre formas orgânicas (biomassa) e inorgânicas (CO2), enquanto o nitrogênio passa por várias transformações entre compostos orgânicos e inorgânicos.
Existe alguma exceção à regra do carbono nos compostos orgânicos?
Sim, alguns compostos contendo carbono, como o dióxido de carbono (CO2), carbonatos e cianetos, são considerados inorgânicos devido à sua estrutura e propriedades.

